Glosario
Marcadores de funcionalidad intestinal
Conceptos generales sobre salud intestinal
Bacterias intestinales
Microbiota intestinal
La microbiota intestinal es decisiva para determinar estados de salud o enfermedad.
Está constituida por un complejo ecosistema de microorganismos que viven sobre la piel y mucosas (aparato digestivo y el aparato genitourinario muy especialmente) y que establecen con el organismo una estrecha relación de mutuo beneficio (simbiosis).
Funciones de la microbiota intestinal
Los microorganismos cumplen importantes funciones:
- Resistencia y control de la colonización por gérmenes patógenos (patógenos facultativos endógenos o propiamente invasores externos).
- Digestión de los alimentos.
- Síntesis de vitaminas y absorción de oligoelementos.
- Estimulación, nutrición y estabilización de la integridad de la barrera epitelial y de su capa mucosa protectora.
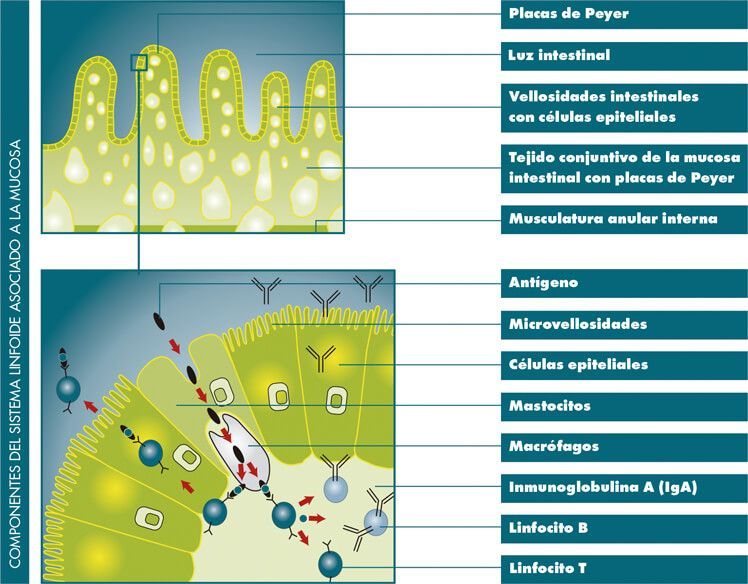
- Estimulación, maduración y diferenciación de linfocitos y diferentes estructuras inmunitarias.
- Estimulación del peristaltismo con ayuda de ácidos grasos de cadena corta.
Para una función intestinal normal, es imprescindible que los diferentes géneros que constituyen la microbiota intestinal (Lactobacillus, Bifidobacterium, Faecalibacterium, Enterococcus, Clostridium etc…) se encuentren en una determinada cantidad, proporción y equilibrio dinámico.
Cada uno de ellos, tiene una función más o menos específica, por lo que tanto el déficit de alguno, como el exceso de otros, pueden dificultar el normal funcionamiento del sistema digestivo.
Microbiota protectora
Este grupo de bacterias son fundamentales para el correcto funcionamiento de toda la microbiota intestinal porque protegen e impiden la colonización y el crecimiento en el intestino, de gérmenes patógenos.
La microbiota protectora, además de las funciones de barrera física e inmunológica, mantiene el pH fisiológicamente ácido en la luz intestinal y la integridad de la barrera selectiva que supone la pared intestinal (permeabilidad intestinal).
Bacterias testadas
- Lactobacillus sp. y Lactobacillus formadores de H2O2: Bacteria anaerobia facultativa y acidificante que coloniza principalmente el intestino delgado. Tienen un papel destacado en el mantenimiento del pH y frente al crecimiento de patógenos.
- Bifidobacterium sp.: Bacteria anaerobia y acidificante que coloniza principalmente el intestino grueso. Destaca su papel en la producción de nutrientes imprescindibles para la mucosa del colon, y que también actúan sobre los procesos inflamatorios locales, y que su elevado número y amplia distribución se consideran fundamentales en la resistencia frente a la colonización de patógenos.
- Bacteroides sp.: Bacteria anaerobia y acidificante, distribuida a lo largo de todo el intestino (delgado y grueso). Destaca su papel en el metabolismo de carbohidratos complejos (facilitando su utilización por parte de otras bacterias) y de las sales biliares, en la producción de sustancias que son fuente de energía y favorecen el tránsito intestinal, y en la síntesis de sustancias antiobacterianas y antimicóticas.
Pueden dañar la microbiota protectora:
- La ingesta de fármacos (principalmente antibióticos y antiinflamatorios).
- Dietas mal balanceadas (sobrecarga de alimentos refinados y lácteos animales, etc.).
- Ingesta de tóxicos (alcohol, tabaco…).
- Estrés.
- Infecciones intestinales (hongos o parásitos).

Un resultado analítico por debajo del rango de normalidad tiene como consecuencia:
- Una disminución de los sistemas protectores de la barrera intestinal, dejando nichos ecológicos libres que pueden ser ocupados por patógenos.
- Esta situación puede favorecer la aparición de una disbiosis que altera el equilibrio del medio interno, produciendo cambios de pH, lo que tiene un efecto negativo sobre el transporte y absorción de macro y micronutrientes.
- Además, debido a la disminución que se produce en la síntesis de ácidos grasos de cadena corta, se altera el aporte energético a las células de la mucosa y puede ser entre otras, causa de estreñimiento.
Microbiota inmunomoduladora
La mucosa del tracto gastrointestinal alberga el mayor arsenal de linfocitos del organismo. Ningún otro órgano es capaz de producir una cantidad tan grande de anticuerpos. Las cepas apatógenas E. coli y Enterococcus actúan como “compañeros” necesarios de estos linfocitos, para el correcto entrenamiento del sistema inmune. La microbiota inmunomoduladora, regula y modula el correcto funcionamiento de todos los componentes de la inmunidad celular y humoral a nivel local (Placas de Peyer, linfocitos intraepiteliales…), induciendo respuestas inmunitarias inespecíficas, manteniendo de esta forma un continuo entrenamiento del sistema inmunitario.
Estas bacterias determinan que la mayoría de sustancias potencialmente antigénicas, ingeridas vía oral, no desencadenen una reacción inmunitaria específica (fenómenos de tolerancia antigénica).
En conjunto, la tasa de colonización en mucho más baja que la que representa la Microbiota protectora, pero juegan un papel fundamental.
Bacterias testadas
- Escherichia coli: Pese a que popularmente es considerada una bacteria exclusivamente patógena, es un integrante normal de la microbiota intestinal, y tiene un destacado papel inmunomodulador, contribuyendo también a la resistencia a la colonización por patógenos.
- Enterococcus sp.: Bacteria también aerobia que se encuentra normalmente en el intestino delgado, con un destacado papel en la producción de anticuerpos locales (IgAs), en la acidificación del medio, y en la resistencia a la colonización por patógenos.
Un resultado analítico por debajo del rango de normalidad aumenta la susceptibilidad del paciente a padecer alteraciones inmunitarias como alergias, patologías autoinmunes o inmunodeficiencias.
Microbiota muconutritiva
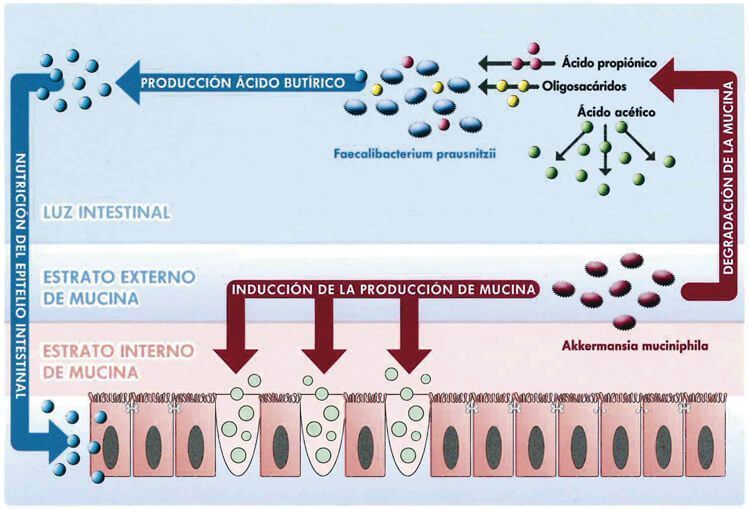
La microbiota muconutritiva desempeña un papel fundamental en el mantenimiento de la integridad de la capa de mucus que tapiza la mucosa intestinal, así como de la propia capa mucosa.
La determinación cualitativa y cuantitativa de las especies microbianas que constituyen la Microbiota muconutritiva, sólo ha sido posible desde fechas recientes, gracias a los avances en técnicas diagnósticas. Se trata de especies que no es posible cultivar en placa y que no ha sido posible determinar y cuantificar de manera habitual hasta la implementación de técnicas PCR (Reacción en Cadena de la Polimerasa).
Bacterias testadas
- Akkermansia muciniphila induce la producción de mucina, favoreciendo la regeneración de la capa de mucus en el intestino, que es el nicho biológico que aloja el resto de microbiota presente en el intestino, así como sus nutrientes. Cataboliza y degrada mucina, produciendo ácidos grasos de cadena corta (AGCC – ácido propiónico, oligosacáridos, y ácido acético -), que sirven de sustrato nutritivo a las bacterias de la microbiota y especialmente de Faecalibacterium prausnitzii.
- Faecalibacterium prausnitzii tiene como papel fundamental la producción de AGCC, en especial de ácido butírico, el cual juega un importante papel en la nutrición y el trofismo del epitelio intestinal, así como en la inhibición de la inflamación de la mucosa de la pared intestinal. Estos ácidos grasos de cadena corta sirven de alimento a Lactobacillus y Bifidobacterium, y cubren el 10% de los requerimientos energéticos del organismo.
Un resultado analítico por debajo del rango de normalidad tiene como consecuencia:
- Una insuficiente nutrición del epitelio intestinal.
- Un déficit en la estimulación de la producción de mucus.
- Aumenta el riesgo de que se produzcan trastornos y falta de protección en la superficie mucosa.
- Favorece la respuesta inflamatoria de la mucosa intestinal.
- Pone en riesgo la función de la barrera intestinal.
Importancia del Ácido Butírico
- Antiinflamatorio
- Estabilización de las mucosas y reparación de la permeabilidad
- Reducción del estrés oxidativo
- Mejora de irrigación de la mucosa intestinal
- Contribuye a la regeneración del mucus
Microbiota proteolítica
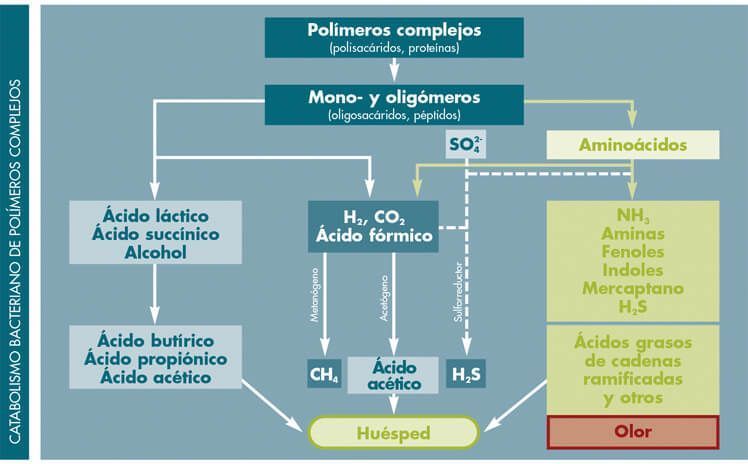
Las bacterias proteolíticas que colonizan de manera natural el intestino, están presentes en muy pequeña cantidad (< 0,01% del total) y se comportan como patógenos facultativos de aumentar su número, ya que alcalinizan el medio intestinal, y de un metabolismo desequilibrado de las proteínas resultan sustancias potencialmente tóxicas (aminas, amoniaco, escatol, etc.) que de poder atravesar la pared intestinal (permeabilidad alterada) pueden traer como consecuencia alteraciones generales orgánicas (inmunitarias, intolerancias alimentarias, etc.).
Bacterias testadas
- Clostridium sp.: Bacteria anaerobia. Metabolizan las proteínas y las grasas, alteran compuestos orgánicos pudiendo generar enzimas procarcinogénicos.
- Coli Biovare, Proteus sp., Pseudomonas sp.: Bacterias aerobias. Metabolizan las proteínas y los hidratos de carbono.
- Otros microorganismos proteolíticos: Bacterias del género Enterobacteriaceae: Klebsiella, Enterobacter, Citrobacter y Serratia. Son aerobias. Metabolizan las proteínas y los hidratos de carbono.
Un resultado por encima del rango de normalidad de una o más bacterias proteolíticas, produce un aumento de los productos alcalinos de degradación de las proteínas, que:
- Alcalinizan el pH fisiológico intestinal, favoreciendo el desarrollo de patógenos.
- Acidifican el pH fisiológico del organismo, por consumo excesivo de bicarbonato circulante.
- Sobrecargan funcionalmente el hígado.
- Lesionan la mucosa de la pared intestinal, pudiendo producir inflamación crónica y alteración de permeabilidad intestinal.
La sobrecarga de proteínas en la dieta, unida a desórdenes de la microbiota protectora y cambios en el pH metabólico, favorecen el crecimiento de bacterias proteolíticas.
En general, su sobrecrecimiento produce un aumento de la carga tóxica del organismo y una sobrecarga hepática. Esto puede ser la causa de trastornos gastrointestinales y síntomas como las malas digestiones, flatulencia, distensión, estreñimiento y/o diarrea y molestias abdominales, a veces muy importantes.
Levaduras
Diagnóstico cuantitativo y cualitativo de hongos y levaduras
Los hongos constituyen una categoría propia de formas de vida. Se diferencian de las plantas, animales y bacterias en su estructura. Sus paredes celulares contienen quitina en lugar de celulosa. Como depósito de sustancias nutritivas no utilizan el almidón, sino el glucógeno.
Colonizan la piel y las mucosas (digestiva, genital, oral…) de nuestro organismo, pudiendo producir patología a este nivel. Que esto ocurra, depende de varios factores cualitativos y cuantitativos endógenos del paciente (disbiosis, patologías crónicas…), además de factores predisponentes (dieta, estilo de vida, ingesta crónica de fármacos…).
Para contener su desarrollo y crecimiento anormal, es determinante que la microbiota saprofita que coloniza las mucosas, esté correctamente distribuida cualitativa y cuantitativamente y que sea funcionalmente activa. De esta forma tendremos una barrera física e inmunológica normal, que controle el crecimiento de hongos y levaduras.
Cándida albicans
El género Candida está formado por más de 200 especies. De todas ellas, Candida albicans es la que tiene la importancia médica más relevante. En el intestino, es fisiológico encontrarla en una cantidad < 103 CFU/gr de heces.
Es un organismo unicelular dimórfico. Candida albicans en la mucosa, se puede comportar como un patógeno facultativo. En su forma de levadura es saprofita e inofensiva, siendo la forma hifal o miceliana la que es patógena e invasiva. Candida albicans es la responsable de entre el 60 y el 75% de todas las micosis.
Los factores predisponentes para la multiplicación no fisiológica de Candida son muchos como: ingesta de fármacos (antibióticos, corticoides, anticonceptivos), sobrecarga de azúcar en la dieta, cambios de pH intestinal, diabetes, embarazo…
Las candidiasis intestinales pueden desarrollarse en silencio durante años, o producir síntomas clínicos banales como fatiga, cefaleas, distensión abdominal, diarreas y/o estreñimiento, acidez, dolores musculoarticulares y molestias vaginales (picores o irritación). Se alimenta de compuestos de la dieta, principalmente carbohidratos simples (glucosa, galactosa, fructosa, celulosa…).
Un estudio bacteriológico adicional, de la microbiota protectora, inmunomoduladora, muconutritiva y proteolítica, es un buen recurso para evaluar si el hallazgo diagnóstico de la Candida, es consecuencia de una alteración en la microbiota intestinal, en cuyo caso será clínicamente más relevante.
Un resultado por encima del rango de normalidad produce:
- Alteraciones metabólicas e inmunitarias.
- Cambios en el pH fisiológico intestinal, favoreciendo el desarrollo de disbiosis.
- Alteración de permeabilidad de la mucosa intestinal.
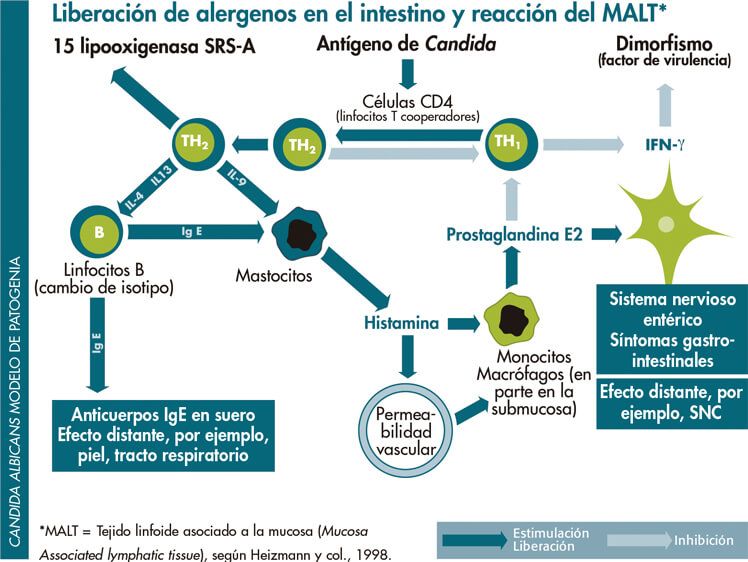
Cándida como factor desencadenante de reacciones alérgicas
Con especial frecuencia se ha observado una asociación entre el sobrecrecimiento de Candida del tracto gastrointestinal y los procesos alérgicos [Palma-Carlos y col., 2002] o síntomas cutáneos (se ha discutido que algunas reacciones alérgicas cutáneas pueden ser causadas por antígenos de Candida, teniendo como fundamento procesos inmunológicos sobre los que puede influir Candida a través del GALT- tejido linfático asociado al intestino.
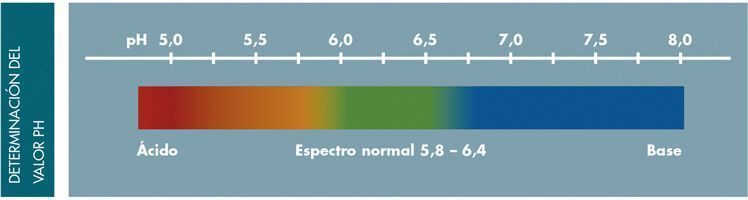
Valor del Ph en las heces
El rango de normalidad oscila entre 5,8 y 6,4.
Un pH ácido, por debajo de 5,8, indica una malabsorción de los hidratos de carbono. Se produce una fermentación parcial de los mismos generando gran cantidad de sustancias ácidas.
Un pH alcalino (básico), por encima de 6,4, indica disbiosis con predominio proteolítico. Los productos finales del metabolismo de las bacterias proteolíticas son potentes alcalinizantes, especialmente el amoniaco.
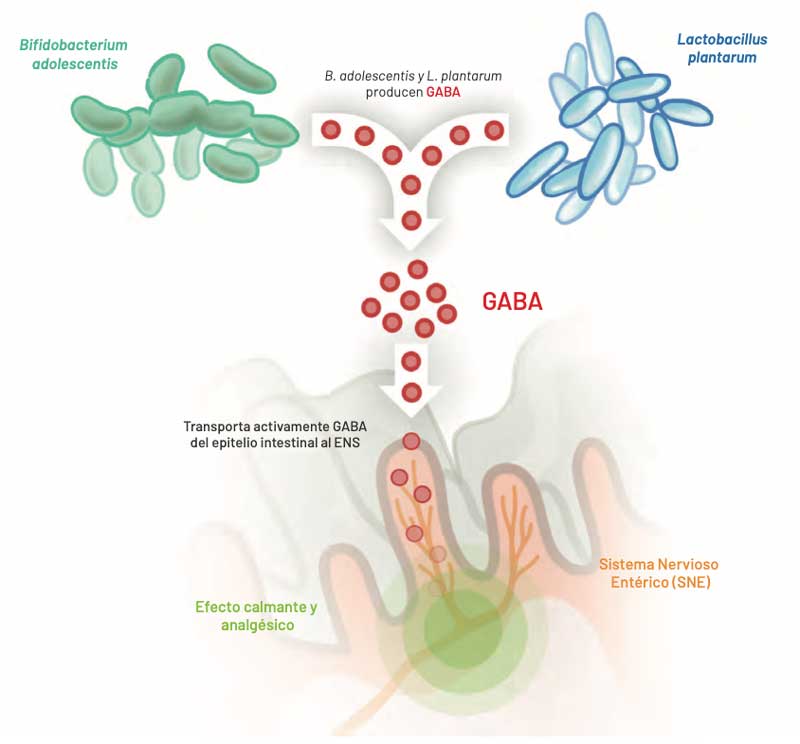
Microbiota neuroactiva
Microbiota productora de ácido γ – aminobutírico (GABA), que actúa a través de receptores en el intestino sobre el eje intestino – cerebro.
Al igual que el organismo humano en el sistema nervioso central diferentes cepas de la microbiota neuroactiva producen la sustancia neurológicamente activa ácido γ – aminobutírico, a veces en grandes cantidades. Esta circunstancia de compartir la capacidad de sintetizar idénticas sustan- cias neuroactivas, supone una especie de “lenguaje común” que permite la comunicación entre ambos, humanos y microorganismos. Los receptores GABA están muy extendidos en el tracto gastrointestinal.
La microbiota neuroactiva puede interactuar con el eje intestino – cerebro de dos formas:
- Las neuronas del sistema nervioso entérico (SNE) reconocen GABA producido por bacterias e ingerido por vía oral, a través de los receptores específicos para el GABA y transmiten los impulsos correspondientes al cerebro a través del nervio vago.
- Al mismo tiempo, el epitelio intestinal reabsorbe GABA hacia la sangre. Estudios recientes han demostrado que pequeñas cantidades de GABA atraviesan la barrera hematoencefálica. El GABA enteral puede apoyar directamente el efecto ansiolítico y antidepresivo del GABA producido por el cerebro.
Así, la microbiota neuroactiva es un modulador importante del eje intestino-cerebro y puede transmitir aspectos promotores de la salud a través del GABA producido en el intestino.
Los receptores GABA también se encuentran en muchas células inmunes como las células dendrí- ticas, los mastocitos y las células T. Por tanto, GABA también participa en la regulación de los procesos inmunitarios, por ejemplo, inhibiendo la liberación de citocinas proinflamatorias.
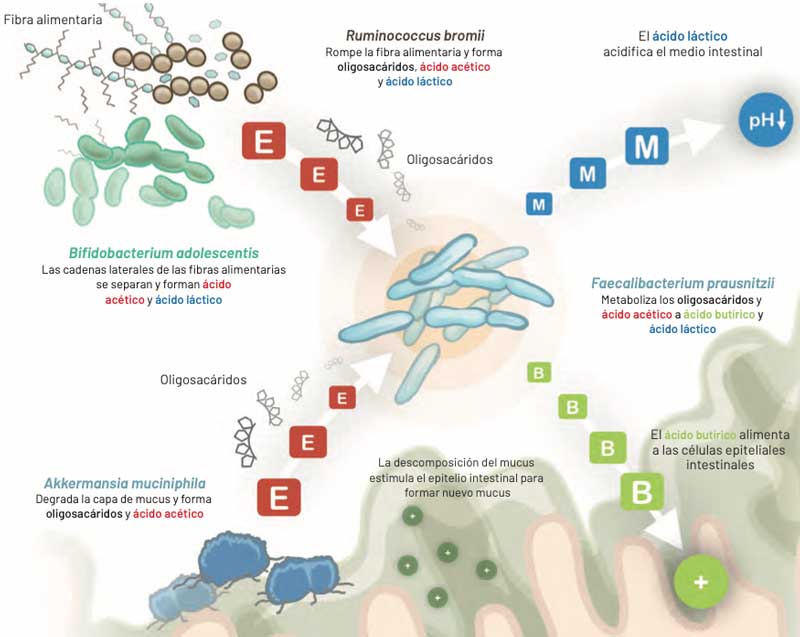
Microbiota sacarolítica primaria
La microbiota sacarolítica primaria apoya la actividad de la microbiota muco- nutritiva al descomponer la estructura de los carbohidratos complejos. Al mismo tiempo, estimula otras especies bacterianas para la degradación de la fibra.
Las enzimas digestivas humanas no pueden descomponer la fibra alimentaria. A lo largo del tracto gastrointestinal esta aumenta el tamaño del quimo, reduce su densidad energética y facilita el control de la glucemia tras su ingesta. El incremento del volumen del contenido intestinal aumen- ta la presión sobre la pared intestinal y estimula el peristaltismo. La actividad de estas bacterias favorece la producción de ácido butírico, micronutriente esencial para la nutrición y estabilidad del epitelio intestinal.
Especialmente algunos tipos de fibras como el almidón resistente y la oligofructosa son converti- dos en ácido butírico y láctico por las bacterias. En particular el almidón resistente se ha descrito que contribuye a reducir la resistencia a la insulina, controlar la diarrea infecciosa y prevenir el cáncer colorrectal.
Bifidobacterium adolescentis y Ruminococcus bromii son bacterias que juegan un papel determi- nante en la degradación primaria del almidón resistente y la oligofructosa.
BIFIDOBACTERIUM ADOLESCENTIS
Actúa sobre las cadenas laterales cortas de los polisacáridos y forma ácido acético a partir de ellas. Faecalibacterium prausnitzii depende del ácido acético para descomponer los oligosacáridos y poder producir ácido butírico a partir de ellos.
RUMINOCOCCUS BROMII
No sólo puede usar el almidón resistente de manera efectiva, sino que también estimula su degradación por otras bacterias intestinales. Estas incluyen Bifidobacterium adolescentis y otras degradadoras de fibra menos eficaces como Eubacterium rectale y Bacteroides thetaiotaomicron. Ruminococcus bromii supone entre el 3 y el 5% de la microbiota total en personas sanas.
Marcadores de funcionalidad intestinal
Zonulina
La zonulina es una proteína involucrada en el funcionamiento de las uniones celulares en el intestino. Es segregada por las células del epitelio intestinal ante determinados estímulos activando la apertura de las uniones intercelulares, permitiendo así la normal absorción de nutrientes.
Estructura de las uniones intercelulares en el intestino:
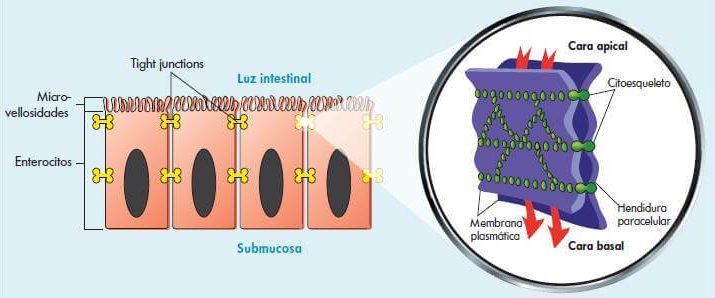
Diferentes estímulos pueden provocar un aumento de la liberación de zonulina, haciendo que las uniones entre las células permanezcan abiertas permitiendo la absorción incontrolada de componentes alimentarios en proceso de digestión o antígenos exógenos, presentes en la luz intestinal – se genera entonces un síndrome de intestino permeable.
La determinación de zonulina es un diagnóstico directo del grado de permeabilidad intestinal y su determinación puede estar indicada en:
- Alergias
- Síntomas y patologías intestinales crónicas
- Síndrome metabólico y diabetes mellitus
- Endotoxemia metabólica y sobrecarga hepática
- Prevención de estas patologías
IgA secretora: Marcador de actividad del sistema inmune de la mucosa
La Inmunoglobulina A secretora (IgAs) es un marcador de actividad del sistema inmune de mucosas. Es sintetizada por las células plasmáticas situadas en la lámina propia de las mucosas y está presente en la mayoría de las secreciones corporales: saliva, lágrimas, mucosidad nasal, mucosidad traqueobronquial, secreciones gastrointestinales, leche materna y calostro. Contribuye de forma determinante a la defensa de infecciones locales y desempeña un papel fundamental en la unión de antígenos procedentes de alimentos en el intestino.
Calprotectina
La calprotectina es una proteína fijadora de calcio y de zinc. Constituye el 60% de las proteínas solubles del citosol de los neutrófilos encontrándose también en monocitos y macrófagos. Es una proteína muy estable, lo cual permite su determinación en heces varios días después de su recogida.
Recientemente estudios defienden el papel de la calprotectina como regulador de la microbiota intestinal especialmente previniendo la translocación bacteriana y controlando la displasia epitelial.
Cuando existe un proceso inflamatorio se produce una migración leucocitaria a la luz intestinal a través de la mucosa inflamada, liberando calprotectina que aumentará su concentración en heces, pudiendo cuantificarse por métodos de ELISA. Es un marcador clásico de inflamación de la mucosa intestinal.
Es un marcador especialmente adecuado en:
- Enfermedad inflamatoria intestinal: La cantidad de Calprotectina, es proporcional a la gravedad de las lesiones y a la extensión de las mismas.
- Dolor abdominal, diarrea crónica y cólico del lactante.
- Lesiones subclínicas en general.
A tener en cuenta sin embargo, es que carece de especificidad ya que refleja la inflamación intestinal cualquiera que sea su causa y que en niños los rangos de normalidad oscilan entre márgenes muy amplios.
Elastasa Pancreática
La enzima elastasa pancreática 1 se produce en el páncreas y es secretada al duodeno a través de la Ampolla de Vater. La enzima ya no puede seguir metabolizándose y por ello puede detectarse en las heces [Loser y col., 1996].
Una concentración reducida es un indicador de una pancreatitis crónica o de una insuficiencia pancreática, que conduciría a una maldigestión que de prolongarse puede desembocar en una malabsorción (con deficiencia de minerales y oligoelementos).
Ácidos biliares
Son esenciales para la digestión de grasas y vitaminas liposolubles. Son alcalinizantes y bactericidas. Se sintetizan en el hígado y la vesícula biliar, se secretan al intestino delgado y gran parte de ellos se reabsorben en íleon distal, de modo que la cantidad eliminada con las heces es reducida.
El aumento de ácidos biliares en las heces, por falta de reabsorción, provoca diarrea, pudiendo provocar una hipovitaminosis, dificultad en la absorción de grasas y vitaminas liposolubles (B12), pérdida de peso, entre otros. Una de las causas más habituales de un aumento de AB en heces es el sobrecrecimiento bacteriano intestinal SIBO (Small Intestine Bacterial Overgrowth).
Residuos digestivos
Normalmente sólo es posible detectar en las heces, mínimas cantidades de residuos de alimentos sin digerir. En las personas sanas, la excreción diaria de grasas, nitrógeno y agua es relativamente constante. Si aumenta hasta concentraciones altas patológicas, puede deberse a un trastorno digestivo en forma de una maldigestión (por insuficiencia pancreática exocrina o deficiencia de ácidos biliares) o malabsorción.
Ácidos grasos ISO
Es un marcador que nos ayuda a saber precozmente si el hígado se encuentra sobrecargado.
Alfa-1-antitripsina
La α-1-antitripsina es un marcador diagnóstico de los trastornos de la permeabilidad de la mucosa en procesos inflamatorios intestinales y en el caso de reacciones alérgicas.
EPX – Proteína eosinofílica
Los eosinófilos aparecen en gran número en los focos de la inflamación y como respuesta a diferentes infestaciones parasitarias. Los gránulos citoplasmáticos que contienen proteínas de carga negativa caracterizan a estas células, que se tiñen fuertemente en contacto con colorantes muy ácidos como la eosina, que les da nombre.
Cuando los eosinófilos liberan estos gránulos aparece entre otras, una proteína muy básica la proteína eosinofílica (EPX), que se ha revelado como idónea para el control del status del proceso inflamatorio. Se produce activación de los eosinófilos en muy diversas patologías inflamatorias, en infecciones bacterianas y parasitarias, y también en algunas enfermedades autoinmunes o en el síndrome de fatiga crónica.
Lactoferrina
Se incluye entre los marcadores inflamatorios. Es una proteína quelante del hierro, del que actúa como transportador. Puede detectarse en numerosos fluidos de secreación como, por ejemplo, la leche materna, lágrimas y saliva.
Tiene un efecto antibacteriano al limitar el acceso de las bacterias al hierro. Es un marcador de la inflamación muy estable, idóneo para muestras de heces, y existen indicios como marcador precoz de la enteropatía inflamatoria crónica.
Lisozima
La lisozima es una enzima que cataliza la degradación de las paredes celulares de algunas bacterias Gram negativas. En heces sirve como indicador de la magnitud de la migración de leucocitos al lumen intestinal. Se ha comprobado un aumento de los valores de lisozima tanto en los pacientes con colitis ulcerosa como en la enfermedad de Crohn.
Sangre oculta
Midiendo si existe sangre en las heces podemos detectar si el aparato digestivo está sangrando en algún punto.
Helicobacter pylori
Es una bacteria que provoca infecciones a nivel estomacal. La presencia de Helicobacter nos indica que existe una disbiosis a nivel intestinal que es conveniente diagnosticar y tratar.
Conceptos generales sobre salud intestinal
Estabilidad del medio intestinal
La estabilidad del medio intestinal permite el correcto funcionamiento del aparato digestivo. Depende de muchos factores como la alimentación, la población de bacterias que habitan en el intestino, el estilo de vida, el estrés y también de factores externos como tóxicos (alcohol y tabaco) y medicamentos.
Síndrome metabólico
Los pacientes afectados de síndrome metabólico padecen síntomas como hipertensión, hipercolesterolemia, obesidad que no responde a dieta, diabetes tipo 2 o hígado graso no alcohólico.
Disbiosis intestinal
Los diferentes grupos bacterianos que habitan el intestino interactúan entre sí, como en un ecosistema. Grupos debilitados de bacterias protectoras favorecen el sobrecrecimiento de otros grupos potencialmente perjudiciales.
Sistema inmune de mucosas
Las mucosas de nuestro organismo están en contacto con millones de microorganismos a diario. El sistema inmune de mucosas se encarga de protegernos frente a los que puedan ser perjudiciales y de obtener información sobre el medio que nos rodea. De esta forma, el sistema inmune aprende frente a qué tiene que protegerse y frente a qué no.
Permeabilidad intestinal
La permeabilidad intestinal permite el paso de sustancias presentes en el intestino hacia la sangre. Si esta permeabilidad aumenta, pueden pasar al organismo sustancias de un tamaño mayor a lo recomendable, lo cual puede desencadenar reacciones inmunitarias, como inflamación silente o alergias a los alimentos.
Micosis intestinal
Presencia de microorganismos fúngicos en el intestino, como por ejemplo hongos o cándida.
Alergias alimentarias IgG
Las alergias mediadas por el anticuerpo IgE provocan reacciones inmediatas como prurito e hinchazón y suelen mantenerse toda la vida. Las alergias mediadas por el anticuerpo IgG pueden provocar reacciones dentro de las primeras 72 horas con síntomas más inespecíficos, como retención de líquidos, diarrea, migrañas. Al contrario que las mediadas por IgE, las alergias mediadas por IgG pueden corregirse con un correcto manejo dietético.
Índice resiliencia
KyberBioma determina la resiliencia de la microbiota intestinal. Describe la estabilidad de un ecosistema para verse afectado frente a diferentes perturba- ciones y renovarse sin cambiar fundamentalmente.
- Si el índice es alto, la microbiota puede mantener su estructura y funciones esenciales a pesar de las posibles influencias perturbadoras.
- Con un índice bajo, la ecología de la microbiota es más lábil y las influencias nocivas pueden generar síntomas clínicos.
Tipo FODMAP
Los FODMAP incluyen:
- Oligosacáridos Fermentables como galacto-oligosacáridos, estaquinosa Disacáridos como lactosa
- Monosacáridos como fructosa
- Polioles como sorbitol, manitol, xilitol, maltitol
Cuando no tenemos los enzimas específicos para digerirlos o sus receptores están saturados, no se produce el normal transporte ni la absorción a nivel del intestino delgado llegando, por tanto, sin cambios al colon.
Estos azúcares son muy osmóticos, el aumento de agua diluye las heces y acelera el tránsito intes- tinal, favoreciendo la diarrea. La microbiota del intestino grueso los fermenta y produce muchos gases, que aumentan la presión sobre la pared intestinal, causando dolor y otros síntomas digesti- vos.
A partir de la composición de la microbiota el valor de tipo FODMAP que evalúa KyberBioma tiene una gran relevancia terapéutica indicando el tipo de dieta FODMAP más recomendada con patolo- gía funcional de intestino.
Según la composición de la microbiota pueden asignarse tres tipos de FODMAP diferentes:
Tipo 1: Los alimentos con FODMAP suelen ser bien tolerados
Es poco probable que una dieta baja en FODMAP proporcione alivio en los síntomas del SII
Tipo 2: Los alimentos con FODMAP son ligeramente tolerados
Es razonable intentar una dieta baja en FODMAP para los síntomas del SII
Tipo 3: Deben evitarse los alimentos con FODMAP
Una dieta baja en FODMAP esta indicada para el alivio de los síntomas del SII
Durante una dieta baja en FODMAP es importante seguir paralelamente una dieta rica en fibra, en apoyo de la microbiota muconutritiva y la microbiota protectora.
